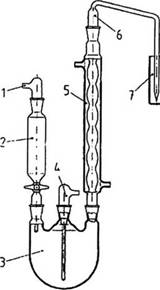
Môi trường nuôi cấy (Culture medium)
Môi trường nuôi cấy là các cơ chất dinh dưỡng được pha chế nhân tạo nhằm đáp ứng cho yêu cầu sinh trưởng, phát triển và sản sinh các sản phẩm trao đổi chất của vi sinh vật. Môi trường dinh dưỡng dùng trong nghiên cứu vi sinh vật và trong quá trình sản xuất các sản phẩm của vi sinh vật. Môi trường dinh dưỡng là yếu tố quan trọng trong công nghiệp lên men, công nghiệp sinh tổng hợp nhờ vi sinh vật.
Môi trường nuôi cấy
Nguyên tắc pha chế môi trường nuôi cấy
1) Chọn các chất dinh dưỡng thích hợp: Nói chung môi trường dinh dưỡng cần đáp ứng các nhu cầu của vi sinh vật về nguồn C, nguồn N, nguồn muối khoáng, nguồn nhân tố sinh trưởng và nước. Vì loại hình dinh dưỡng của vi sinh vật là phức tạp, các vi sinh vật khác nhau có những yêu cầu không giống nhau về các chất dinh dưỡng cho nên có rất nhiều công thức pha chế môi trường nuôi cấy. “Sách Danh lục môi trường nuôi cấy” (A Compilation of Culture Media) xuất bản từ năm 1930 cũng đã ghi tới trên 2500 loại môi trường nuôi cấy khác nhau.
Môi trường nuôi cấy vi sinh vật tự dưỡng hoàn toàn pha chế từ các hợp chất vô cơ. Ví dụ để nuôi cấy vi khuẩn Thiobacillus thiooxidans gồm có các thành phần như sau (g/l): (NH4)2SO4 -0.4; MgSO4.7H2O - 0,5; FeSO4 - 0,01; KH2PO4 - 4; CaCl2 - 0,25; S- 10; pH: 7,0, khử trùng ở 121° C trong 20 phút. Các vi khuẩn này sử dụng CO2 trong không khí (hay hòa tan trong nước) để cung cấp nguồn carbon. Với các vi sinh vật tự dưỡng quang năng ngoài việc cung cấp các chất dinh dưỡng cần tiết còn cần chiếu sáng để cung cấp năng lượng cho chúng. Đối với vi sinh vật dị dưỡng cần cung cấp chất hữu cơ và nhu cầu dinh dưỡng của các nhóm khác nhau là rất khác nhau. Để nuôi cấy vi khuẩn Escherichia coli có thể dùng môi trường khá đơn giản sau đây (g/l): Glucose - 5; NH4H2PO4- 1; MgSO4.7H2O - 0,2; K2HPO4 - 1; NaCl - 5; pH: 7,0-7,2, khử trùng ở 112° C trong 30 phút. Nhưng cũngcó những vi khuẩn dị dưỡng yêu cầu những môi trường nuôi cấy rất phức tạp. Ví dụ vi khuẩn Lactobacillus bifidus cần môi trường sau đây (trong 1 lít môi trường đậm đặc gấp đôi) : K2HPO4 - 5g; Na-Acetat - 50g; NZ Case Peptone- 10g; Lactose- 70g; Alanin, Cystin, Tryptophan- mỗi loại 0,4g; Asparagin- 0,2g; Xanthin, Adenin, Guanin, Uracin - mỗi loại 0,02g; Dung dịch Muối B- 10ml; Pyridoxin-HCl - 2,4mg ; Tiamin-HCl - 0,4mg; Riboflavin- 0,4mg; Acid nicotinic- 1,2mg; Ca-Pentotenat - 0,8mg ; Biotin- 8,0 mcg (microgram); Acid folic- 20 mcg; Acid p-aminobenzoic- 20 mcg; Tween 80 - 1g. Điều chỉnh pH đến 6,8. Thêm bằng thao tác vô trùng 100ml dung dịch Acid ascorbic 1% đã lọc qua nến lọc vi khuẩn. Điều chỉnh đến pH 6,5. Lại thêm bằng thao tác vô trùng Sữa người đã loại kem sao cho nồng độ đạt được là 2%. Dung dịch Muối B có thành phần như sau (g/l): MgSO4.7H2O-10; FeSO4.7H2O-0,5; NaCl-0,5; MnSO4.2H2O- 0,337.
Thông thường để thay cho các nhân tố sinh trưởng người ta thường dùng Peptone (thay cho từng aminoacid) và cao nấm men (thay cho các nhân tố sinh trưởng). Môi trường thường dùng để nuôi cấy các vi khuẩn dị dưỡng là Môi trường Cao thịt-Pepton với thành phần như sau (g/l): Cao thịt (Beef extract) - 5; Peptone- 10; NaCl- 5; pH: 7,0-7,2; khử trùng ở 121° C trong 20 phút. Môi trường để nuôi cấy vi khuẩn Brevibacterium spp. có thành phần như sau (g/l): Cao nấm men (Yeast extract)-10; Glucose- 20; CaCO3 - 20.
Người ta chia môi trường nuôi cấy thành nhiều loại khác nhau.
- Căn cứ vào thành phần môi trường ta có: môi trường thiên nhiên, môi trường tổng hơp.
Môi trường thiên nhiên (complex medium): đây là loại môi trường chứa các chất hữu cơ thiên nhiên không biết rõ thành phần hóa học hoặc thành phần hóa học không ổn định, vì vậy còn được gọi là môi trường không xác định về hóa học (chemically undefined medium). Các môi trường Cao thịt-Pepton, môi trường Mạch nha, môi trường LB (Luria-Bertani) là các ví dụ của loại môi trường này. Thành phần của môi trường LB là như sau (g/l): Peptone - 10; Cao nấm men - 5; NaCl -10; pH: 7,0; khử trùng ở 1210C trong 21 phút. Cao thịt là nước chiết thịt được cô đặc lại. Cao thịt chứa các chất đạm hữu cơ, đường, vitamin, muối khoáng- tất cả đều dễ tan trong nước. Peptone là dạng thủy phân bằng protease hay bằng acid đối với thịt, casein, gelatin sau đó làm khô lại thành dạng bột. Peptone chứa phong phú các chất đạm hữu cơ, cũng có một số vitamin và đường. Cao nấm men là dịch tự phân (autolysate) tế bào nấm men được cô đặc lại. Cao nấm men chứa phong phú vitamin nhóm B, cũng có chứa các chất đạm hữu cơ và đường.
Ngoài các loại nói trên môi trường thiên nhiên còn được chế tạo từ các nguyên liệu khác như nước chiết khoai tây, nước chiết giá đậu, nước chiết đất, nước chiết rơm rạ, nước chiết lông vũ bột ngô, cám gạo, sữa, huyết thanh, nước ép cà rốt, nước dừa. Vi sinh vật ưa phân (coprophilous microorganisms) có thể dùng nước phân làm chất dinh dưỡng. Giá thành của môi trường thiên nhiên thường thấp, cho nên không chỉ được sử dụng trong phòng thí nghiệm mà còn có thể được sử dụng trong các xí nghiệp lên men công nghiệp.
Bảng 13.17: Thành phần một số loại peptone và dịch thủy phân protein
| Chế phẩm(CP) | Phản ứng Biure |
| Các thành phần (% trong protein) |
| (1) | (2) | (3) |
| Peptone Pharmacon | + | 63.5 | 9.7 | 27.8 |
| Peptone Vitte | + | 44.1 | 26.7 | 29.2 |
| Peptone Canbaum | + | 40.2 | 27.4 | 32.4 |
| Peptone Gee | + | 44.5 | 23.2 | 32.3 |
| Peptone Roche | + | 25.3 | 11.7 | 63.0 |
| CP thủy phân nhờ pepsin | + | 42.1 | 25.2 | 32.7 |
| CP thủy phân nhờ trypsin | + | 2.0 | 14.9 | 82.1 |
| Dịch thủy phân gluten | - | 0 | 0 | 100 |
| Dịch thủy phân gelatin | - | 0 | 0 | 100 |
Chú thích:
(1)- Các polypeptid cao phân tử được kết tủa bằng tannin khi có mặt 2% H 2 SO 4 .
(2)- Các polypeptid được kết tủa bằng tannin khi môi trường có phản ứng trung tính.
(3)- Các aminoacid tự do và các peptid không bị ết tủa bởi tannin.
Môi trường tổng hợp (synthetic medium): đây là loại môi trường có thành phần hóa học được biết rõ cho nên còn được gọi là môi trường xác định về hóa học (chemically defined medium). Ví dụ môi trường Gause thích hợp cho Xạ khuẩn với thành phần như sau (g/l): Tinh bột tan - 20; KNO3 - 1; NaCl - 0,5; K2HPO4 .3H2O- 0,5; K2HPO4 .3H2O- 0,5; FeSO4 .7H2O- 0,01, pH: 7,2-7,4; khử trùng ở 1210C trong 21 phút. Môi trường tổng hợp có giá thành cao và trên loại môi trường này vi sinh vật phát triển tương đối chậm, nói chung thích hợp sử dụng trong phạm vi phòng thí nghiệm.
Có những vi khuẩn đòi hỏi các môi trường tổng hợp khá đơn giản, chẳng hạn như vi khuẩn Escherichia coli với môi trường sau đây: K2HPO4-7,0g; KH2PO4-2,0g; (NH4)2SO4-1,0g; MgSO4-0,1g; CaCl2-0,02g; Glucose-4-10g; Nguyên tố vi lượng (Fe,Co,Mn,Zn,Cu,Ni,Mo)-mỗi loại 2-10μg; Nước cất- 1000ml.
Es cherichi a coli
Có những vi sinh vật đòi hỏi các môi trường tổng hợp rất phức tạp (và đắt tiền). Sau đây là ví dụ về môi trường tổng hợp dùng để nuôi cấy vi tảo Euglena: acid glutamic-6g; acid aspartic-4g; Glycine-5g; Sacchaose-30g; Acid malic-1,04g; Acid boric-1,14mg; Thiamine HCl-12mg; KH2PO4- 0,6g; MgSO4-0,8g; CaCO3-0,16g; (NH4)2CO3- 0,72g; FeCl3-60mg; ZnSO4- 40mg; MnSO4-6mg; CuSO4- 0,62mg; CoSO4- 5mg ; (NH4)2MoO4- 1,34mg; Nước 1000ml.
Một ví dụ khác về môi trường tổng hợp để nuôi cấy vi khuẩn Leuconostoc mesenteroides: K2HPO4- 0,6g; KH2PO4- 0,6g; NH4Cl- 3g; MgSO4- 0,1g; Glucose- 25g; Na acetate- 20g; Các amino acid- mỗi loại 100-200μg (gồm có alanine, arginine, asparagine, aspartate, cysteine, glutamate, glutamine, glycine, histidine, isoleucine, leucine, lysine, methionine, phenylalanine, proline, serine, threonine, tryptophane, tyrosine, valine); Purinevaf Pyrimidine – mỗi loại 10mg (gồm có adenine, guanine, uracil,xanthine); Vitamin- mỗi loại 0,01-1mg (gồm có biotin, folate, nicotinic acid, pyridoxal, pyridoxamine, pyridoxine, ribolavine, thiamine, pantothenate, para-aminobenzoic acid). Nguyên tố vi lượng - mỗi loại 2-10μg; Nước cất- 1000ml.
- Căn cứ vào trạng thái của môi trường người ta chia ra thành môi trường đăc, môi trường bán đặc và môi trường dịch thể.
Môi trường đặc (solid medium): đây là loại môi trường được làm đông đặc lại nhờ có bổ sung thêm thạch (agar-agar), gelatin hay silica gel. Môi trường đặc phải đảm bảo được các yêu cầu sau đây:
- Không bị vi sinh vật nuôi cấy sử dụng.
Rau câu chỉ vàng
-Giữ được trạng thái đặc trong nhiệt độ nuôi cấy vi sinh vật. Dễ hòa tan khi đun nóng (thường được điều chỉnh bằng lượng chứa chất làm đặc trong môi trường)
-Nhiệt độ để làm đặc môi trường không quá thấp.
-Chất làm đặc môi trường không có hại đôi với vi sinh vật
-Chất làm đặc không bị phá hủy khi khử trùng môi trường
-Giữ được trạng thái trong suốt của môi trường.
-Giá thành không quá cao, pha chế môi trường dễ dàng.
Thạch là sản phẩm chế tạo từ Rau câu chỉ vàng (Gracilaria verucosa) hay các tảo biển khác thuộc chi Gracilaria hay Gelidium. Thạch có chứa khoảng 70% agarose và khoảng 30% agaropectin. Để làm tan thạch cần đun môi trường đến 1000C và để làm giữ môi trường thạch ở trạng thái lỏng cần giữ ở nhiệt độ khoảng 50-600C (trong nồi cách thủy). Để làm cho môi trường đặc lại cần hạ nhiệt độ xuống 40-450C. Tùy chất lượng của thạch mà khi làm môi trường người ta cho vào với tỷ lệ 15-20g/l. Khi cần nuôi cấy vi sinh vật trên các môi trường thạch có pH từ 6 trở xuống thì cần điều chỉnh môi trường tới pH trung tính trước khi khử trùng, sau đó mới điều chỉnh lại đến pH thích hợp (nếu không thạch có bị thủy phân trong điều kiện pH thấp và ở nhiệt độ cao).
Hình 13.4: Robert Koch (1843-1910)
Người đầu tiên nghĩ đến sử dụng môi trường đặc trong nghiên cứu vi sinh vật là Robert Koch khi tình cờ thấy các khuẩn lạc của vi khuẩn trên củ khoai tây và ông đã dùng các lát khoai tây để làm môi trường phân lập vi khuẩn vào năm 1881. Người đầu tiên dùng gelatin để chế tạo môi trường đặc cũng vào năm này là một trợ lý của Koch, ông Frederick Loeffler. Việc dùng thạch để làm chất đông đặc là do cô Minora Tarazaemon phát hiện; khi nấu thức ăn với tảo biển và khi để nguội cô thấy thức ăn đông đặc lại (1882). Người đầu tiên dùng thạch thay thế gelatin trong môi trường nuôi cấy là vợ của Walther Hess (một trợ lý khác của Koch) - bà Fannie Eilshemius Hess.
Sau đây là vài đặc điểm chủ yếu của Thạch và Gelatin:
| Đặc điểm | Thạch | Gelatin |
| Nồng độ thường dùng (%) | 1,5-2,0 | 5-12 |
| Nhiệt độ hòa tan ( 0 C) | 96 | 25 |
| Nhiệt độ đông ( 0 C) | 40 | 20 |
| pH | Hơi acid | Acid |
| Chất khoáng (%) | 16 | 14-15 |
| CaO (%) | 1,15 | 0 |
| MgO (%) | 0,77 | 0 |
| N (%) | 0,4 | 18,3 |
| Vi sinh vật có thể sử dụng làm chất dinh dưỡng | Tuyệt đại đa số không sử dụng | Nhiều vi sinh vật có thể sử dụng |
Môi trường bán đặc (semisolid medium):
Môi trường bán đặc là môi trường chỉ chứa 0,2-0,7% thạch và thường được sử dụng để quan sát khả năng di động của vi sinh vật, quan sát hiệu giá thực khuẩn thể (phage)...
Môi trường dịch thể (liquid medium):
Môi trường dịch thể hay môi trường lỏng là các môi trường không bổ sung các chấy làm đông đặc môi trường. Để thông khí phải dùng tới máy lắc hay các nồi lên men có hệ thống thổi khí vô trùng (vô khuẩn) và hệ thống khuấy đảo làm tan đều bọt khí. Môi trường dịch thể ngoài việc sử dụng trong nghiên cứu tại phòng thí nghiệm còn được sử dụng rộng rãi trong sản xuất lớn tại các nhà máy lên men công nghiệp.
- Căn cứ vào mục đích sử dụng người ta chia môi trường nuôi cấy thành nhiều loại khác nhau
Môi trường cơ sở (minimum medium): Các vi sinh vật tuy có yêu cầu dinh dưỡng không giống nhau nhưng nói chung về cơ bản thì các chất dinh dưỡng là giống nhau. Môi trường cơ sở là môi trường có chứa các chất dinh dưỡng cơ bản cần thiết cho sự sinh trưởng, phát triển của đa số vi sinh vật. Môi trường cơ sở thông dụng là Môi trường cao thịt - peptone. Môi trường cơ sở được dùng làm thành phần cơ bản cho những môi trường đặc biệt, tùy theo yêu cầu của từng nhóm vi sinh vật mà bổ sung thêm các chất dinh dưỡng cần thiết.
Môi trường làm giàu hay còn gọi là môi trường gia phú (enrichment medium): Trên môi trường cơ sở cho thêm một số chất dinh dưỡng đặc biệt để thích hợp với việc nuôi cấy một số nhóm vi sinh vật. Các chất bổ sung thêm có thể là máu, huyết thanh, cao nấm men, mô động vật hay thực vật. Ví dụ để nuôi cấy vi khuẩn Bordetella pertussis người ta dùng môi trường cơ sở Difco 0048 nhưng bổ sung bằng thao tác vô trùng máu thỏ (đã lọc qua nến lọc) sau khi đã khử trùng môi trường 15 phút ở 1210C, sao cho nồng độ cuối là 15%.
Bo rdetella pertussis
Môi trường giám biệt (differential medium)
Môi trường giám biệt dùng trong việc giám định các loài vi sinh vật khác nhau để xác định vị trí phân loại của chúng. Các môi trường giám biệt và phương pháp sử dụng đã được trình bày trong Tập I (Thế giới vi sinh vật). Chẳng hạn khi xác định khả năng sinh protease thì bổ sung casein hay gelatin, khả năng sinh amylase thì thêm tinh bột tan, khả năng sinh lipase thì thêm dầu ăn và chỉ thị màu, khả năng sinh H2S thì thêm Pb acetat, ..Người ta thường dùng môi trường EMB (Eosin Methylene Blue) để giám biệt vi khuẩn đường ruột. Môi trường này có thành phần như sau: Peptone-10g; Lactose-5g; Saccharose-5g K2HPO4- 2g; EosinY-0,4g; Methylene Blue-0,065g; Nước cất-1000ml; pH=7,2. Môi trường này ức chế vi khuẩn Gram (+) và một số vi khuẩn Gram (-). Từ môi trường này kiểm tra thêm một vài thí nghiệm với các khuẩn lạc xuất hiện có thể phân lập được nhiều loại vi khuẩn đường ruột Gram (-) theo sơ đồ sau đây:
a- Lên men lactic, sinh acid.
b- Sinh acid mạnh,khuẩn lạc chiếu sáng thấy có màu tía, phản quang có màu lục ánh kim ...Escherichia coli
bb-Sinh acid yếu, khuẩn lạc có màu nâu gụ ...Enterobacter,Serratia, Klebsiella, Hafnia
aa- Không lên men lactic, không sinh acid, khuẩn lạc trong vô màu... Proteus, Salmonella, Shigella.
Môi trường chọn lọc (Selective medium)
Dùng môi trường chọn lọc để phân lập từng nhóm vi sinh vật riêng biệt từ một quần thể vi sinh vật trong tự nhiên. Dựa vào yêu cầu dinh dưỡng đặc biệt của từng nhóm vi sinh vật hoặc tính mẫn cảm khác nhau đối với hóa chất, với chất kháng sinh mà đưa thêm vào môi trường những chất tương thích, nhằm ức chế sự sinh trưởng của các nhóm vi sinh vật khác và giúp cho phân lập được nhóm vi sinh vật cần nghiên cứu. Có những môi trường chọn lọc được thiết kế dựa trên nhu cầu dinh đưỡng đặc biệt của từng nhóm vi sinh vật nhất định. Ví dụ dùng cellulose hay dầu parafin làm nguồn carbon duy nhất khi phân lập nhóm vi sinh vật phân hủy celluose hay phân hủy parafin, dùng protein làm nguồn nitrogen duy nhất để phân lập vi sinh vật sản sinh proteinase, dùng môi trường không chứa nitrogen để phân lập vi sinh vật cố định nitrogen. Ví dụ môi trường vô đạm Ashby dùng để phân lập vi khuẩn Azotobacter có thành phần như sau: Mannit-1%; KH2PO4-0,025%, MgSO4.7H2O-0,02%; NaCl-0,02%; CaSO4.2H2O-0,01%; CaCO3-0,5%.
Cũng có loại môi trường chọn lọc thêm 10% phenol sẽ làm ức chế sự sinh trưởng của vi khuẩn và vi nấm nhưng lại có thể phân lập được xạ khuẩn. Nếu thêm vào môi trường Bi sulphat thì có thể ức chế được các vi khuẩn Gram (+)và phần lớn các vi khuẩn Gram (-), nhưng lại phân lập được vi khuần thương hàn (Salmonella typhi). Thêm vào môi trường Brilliant green hay Crystal violet thì ức chế được vi khuẩn Gram (+) nhưng lại phân lập được vi khuẩn Gram (-). Trêm vào môi trường Streptomycin thì có thể ức chế được nhiều loại vi khuẩn nhưng lại phân lập được vi nấm. Thêm vào môi trường Na propionat có thể ức chế được nấm sợi nhưng lại phân lập được nấm men. Trong Kỹ thuật di truyền (Genetic engineering) người ta thường xuyên sử dụng các môi trường chọn lọc chứa các kháng sinh xác định để tách ra các chủng mang gen tái tổ hợp.
Trong thực tế có những môi trường vừa là môi trường chọn lọc, vừa là môi trường giám biệt. Ví dụ để phân lập tụ cầu khuẩn vàng (Staphylococcus aureus) người ta thêm vào môi trường 7,5% NaCl, Mannit và chỉ thị màu acid-kiềm. Vi khuẩn này vừa chịu được nồng độ NaCl cao , vừa chuyển hóa mannit thành acid.
Staph ylococcus aur eus
Sau đây là một số chất được bổ sung vào môi trường (MT) chọn lọc khi cần thiết để phân lập một số nhóm vi sinh vật nhất định: Potassium tellurite (MT Mueller tellurite) để phân lập Corynebacterium diphtheriae; Tellurite và Crystal violet (MT Mitis-salivarius) để phân lập Streptococcus; Na azide (MTAzide glucose) để phân lập Streptococcus; Phenylethanol (MT Phenylethanol) để phân lập Staphylococcus và Streptococcus; Nước ép cà chua (MT nước ép cà chua) để phân lập vi khuẩn lactic từ nước bọt; Desoxycholate, citrate (MT Desoxycholate citrate) để phân lập vi khuẩn đường ruột Gram(-); Mật(bile),citrate, brilliant green (MT SS) để phân lập Salmonella và Shigella; Malachite green dye (MT Lowenstein-Jensen) để phân lập Mycobacterium; Chloramphenicol (MT Emmon) để phân lập nấm; Rose Bengal và Streptomycin (MT Martin) để phân lập nấm...
Corynebacterium diphtheriae
Ngoài các loại môi trường kể trên còn có các loại môi trường đặc biệt khác. Đó là Môi trường phân tích (assay medium) dùng để định lượng vitamin, chất kháng sinh... Đó là Môi trường khử (reduced medium) dùng để nuôi cấy các vi sinh vật kỵ khí. Đó là Môi trường nuôi cấy mô (Tissue-culture medium) chuyên phục vụ cho việc nuôi cấy tế bào và mô động, thực vật, hoặc dùng để nuôi cấy trên tế bào các nhóm vi sinh vật chuyên ký sinh như virút, Chlamydia, Rickettsia, Spirochete. Một số virút và Rickettsia không phát triển được trên các môi trường nhân tạo mà phải nuôi cấy trên phôi gà, trên tế bào thận khỉ, trên cơ thể động vật thực nghiệm.
Dưới đây là một vài gợi ý quan trọng khi chuẩn bị môi trường nuôi cấy.
Rất nhiều đường dễ bị phân giải trong quá trình khử trùng ở pH kiềm (đặc biệt với sự có mặt của photsphate và peptone), làm cho màu môi trường chuyển thành màu nâu và các sản phẩm tạo thành có thể ức chế sự sinh trưởng của vi sinh vật. Để tránh tình trạng đó, người ta khử trùng ở môi trường pH acid nhẹ hoặc khử trùng riêng biệt đối với đường.
Tất cả các kim loại vi lượng dễ dàng tạo nên muối photphat không tan và kết tủa trong môi trường nuôi cấy. Điều này có thể được tránh bằng cách bổ sung thêm các nhân tố có ái lực với kim loại (metal-chelating agents) như là EDTA (Ethylene Diamine Tetraacetic Acid) hay NTA (Nitrilotriacetic acid) hay đôi khi là các axit cacboxylic như citrate hay tartrate. Việc thêm các nhân tố này có hiệu quả hai mặt. Một mặt, nó ngăn chặn sự kết tủa của các kim loại vi lượng, mặt khác nó hoạt động giống như một bể chứa các kim loại đó, bằng cách này có thể làm giảm tính độc nhờ giảm nồng độ tự do của chúng (tới mức mà các vi sinh vật có thể sử dụng được).
Ở môi trường pH >7, các kim loại kiềm thổ Ca và Mg (dưới dạng vi lượng) dễ dàng kết tủa với sự hiện diện của photphate (hay sự có mặt của ion carbonate khi sử dụng môi trường đệm là bicarbonat, hay có sẵn trong nước cứng) tạo nên hàm lượng muối không tan cao. Những kết tủa này đôi khi khó thấy bằng mắt thường, đặc biệt trong các bình nuôi cấy lắc do thể tích nhỏ của môi trường. Để tránh điều này, môi trường có thế được khử trùng ở pH hơi axit (pH được điều chỉnh sau), hay muối photphat được khử trùng riêng rẽ với môi trường và kết hợp sau khi đã làm nguội.
Cần chú ý rằng đa số các môi trường cổ điển sử dụng trước những năm 60 của thế kỷ trước thường không bao gồm các nguyên tố vi lượng. Sự thêm vào thường là không cần thiết bởi vì các nguyên tố vi lượng đã có chứa sẵn trong các muối không tinh sạch được sử dụng để chuẩn bị cho môi trường. Môi trường hiện nay được chuẩn bị với các muối tinh sạch cao nên không đáng ngạc nhiên là sẽ thất bại trong việc tạo ra nhiều sinh khối sản phẩm nếu không được bổ sung các nguyên tố vi lượng vào trong môi trường. Một ví dụ điển hình là môi trường cổ điển M9 được sử dụng rất rộng rãi cho sự sinh trưởng của E.coli trong các nghiên cứu di truyền. Môi trường này không cung cấp thuận lợi các nguyên tố vi lượng cho sự phát triển của E.coli trong một vài thế hệ, sau đó chúng sinh truởng chậm lại và cuối cùng là ngừng lại.
GS. Nguyễn Lân Dũng
Liên hệ:
Hotline (Zalo, Viber, Phone): 0903.71.51.78
Skype: Quocthinh,le
Email: Thinh.lq@htvsci.com